El Rabdomiosarcoma (RMS) és un càncer molt maligne que típicament es desenvolupa a partir de cèl·lules musculars esquelètiques i que pot sorgir en diferents parts del cos. És més freqüent en nens i representa el 5% de tots els tumors pediàtrics. Els tractaments actuals pel RMS inclouen quimioteràpia, radiació i cirurgia. No obstant això, les taxes de supervivència dels pacients d’alt risc no han millorat en les últimes dècades, i els pacients recalcitrants/amb recaiguda presenten un mal pronòstic, ja que la seva resposta als tractaments actuals és sovint insuficient per evitar el desenvolupament del càncer.
Ara, els investigadors de l’IBEC Clara Alcon, Albert Manzano, Josep Samitier i Joan Montero, del grup Nanobioenginyeria, juntament amb investigadors dels instituts VHIR, IDIBELL i IRSJD, associats a hospitals, publiquen a Cell Death & Disease, una revista del grup editorial Nature, un estudi que troba una nova combinació seqüencial de medicaments efectiva per a aquesta malaltia. L’agent quimioterapèutic vincristine, actualment utilitzat per tractar el RMS, amb el S63845, que mimetitza el BH3, van ser efectius tant in vitro com in vivo contra el RMS. Aquesta estratègia augmenta l’eficàcia dels tractaments actuals a la vegada que disminueix la toxicitat induïda per la teràpia.
La clau d’un tractament eficaç és afavorir la mort per apoptosi en les cèl·lules canceroses
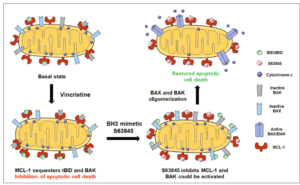
La teràpia causa la mort de les cèl·lules canceroses principalment per apoptosi, un procés controlat per la família de proteïnes BCL-2. No obstant això, l’evasió de l’apoptosi és una característica dels càncers humans, i sovint és promoguda per un augment de l’expressió de proteïnes antiapoptòtiques de la família BCL-2. La cerca de proteïnes antiapoptòtiques representa un enfocament terapèutic prometedor per tractar pacients RMS d’alt risc o amb reincidència. En aquest sentit, una nova classe de teràpies que inhibeixen amb precisió les proteïnes antiapopòtiques BCL-2, les anomenades BH3 mimètiques, podrien ser utilitzades per superar la resistència al tractament. Aquest enfocament té un gran potencial terapèutic, però el principal repte és guiar de manera efectiva l’ús de BH3 mimètics a la clínica.
Per resoldre aquest problema, en aquest recent treball els investigadors de l’IBEC han utilitzat perfils BH3 dinàmics (DBP) – un biomarcador predictiu funcional – per identificar adaptacions antiapoptòtiques en el tractament. Utilitzant aquesta tecnologia, els autors podrien determinar la sensibilitat a la BH3 mimètica, i superar la resistència RMS a la quimioteràpia. Específicament, van trobar que l’inhibidor MCL-1 S63845 millora de forma sinèrgica l’efecte de la vincristina, un dels medicaments més utilitzats clínicament per tractar el RMS tant in vitro com in vivo.
Els pèptids sintètics poden predir quan les cèl·lules tumorals deixaran de respondre al tractament
En aquest treball els investigadors han estudiat l’ús de BH3 mimètics per augmentar la sensibilitat del RMS a la quimioteràpia actual. Van identificar adaptacions antiapoptòtiques a teràpies comunes com la vincristina i la doxorubicina i les van provar en combinació amb BH3 mimètics. Van aconseguir una alta citotoxicitat, al voltant del 80%, disminuint deu vegades la seva concentració, i per tant els seus possibles efectes secundaris a la clínica.
Els autors van trobar tres noves combinacions de fàrmacs actualment utilitzats per tractar el RMS (que indueixen l’apoptosi) amb inhibidors antiapoptòtics específics, que van matar cèl·lules canceroses sense afectar les sanes. A més, aquestes combinacions quan s’aplicaven de forma seqüencial actuaven sinèrgicament, cosa que permetia una reducció de la dosi. Aquest és un aspecte clau de l’estudi, ja que els efectes secundaris derivats de l’administració de quimioteràpia en nens són greus i poden incloure infertilitat, cardiomiopatia o l’aparició d’altres càncers. Utilitzant aquesta nova metodologia, el temps i la dosi de l’administració de medicaments es poden optimitzar per a reduir aquests efectes secundaris no desitjats.
Utilitzant la nostra tècnica vam ser capaços de mesurar l’efectivitat d’un tractament, i el més important, vam poder detectar adaptacions de resistència en cèl·lules tumorals que promouen la supervivència del càncer.
Clara Alcon, investigadora de l’IBEC i primera autora de l’estudi.
Aquesta estratègia va ser validada in vivo en un model xenògraf derivat d’un pacient amb RMS, on algunes cèl·lules del tumor del pacient van ser implantades i ampliades en ratolins. Aquesta tècnica proporciona més material per ser utilitzat al laboratori i és avantatjosa en la recerca preclínica, ja que recapitula la resposta terapèutica dels pacients. Els autors van observar in vitro una reducció en el creixement del tumor després de la combinació seqüencial de l’inhibidor de la vincristina i de l’inhibidor MCL-1 S63845 en comparació amb el tractament amb un sol agent.
Aquestes troballes, juntament amb els esforços actuals amb els inhibidors de MCL-1, actualment explorats en assaigs clínics, demostren la importància de combinar racionalment agents anticancerosos amb BH3 mimètics. Aquestes noves estratègies terapèutiques podrien millorar el tractament dels pacients RMS a la clínica, incloent-hi els que presenten recaigudes, si es guien per un biomarcador funcional predictiu efectiu com ara un perfil de BH3 dinàmic.
Joan Montero, cap del grup Nanobioenginyeria i investigador responsable de l’estudi.
Article de referència: Clara Alcon, Albert Manzano-Muñoz, Estela Prada, Jaume Mora, Aroa Soriano, Gabriela Guillén, Soledad Gallego, Josep Roma, Josep Samitier, Alberto Villanueva, Joan Montero. Sequential combinations of chemotherapeutic agents with BH3 mimetics to treat Rabdomiosarcoma and avoid resistance. Cell Death and Disease (2020) 11:634.
Aquest treball es va fer en col·laboració amb el Laboratori de la Biologia del Desenvolupament del Tumor, Institut de Recerca Sant Joan de Déu; Departament d’Hematologia i Oncologia, Hospital Sant Joan de Déu; Grup de Recerca translacional en càncer en la infància i l’adolescència, Institut de Recerca Vall d’Hebron (VHIR); Departament de Cirurgia, Universitat Autònoma de Barcelona (UAB); Departament d’Electrònica i Enginyeria Biomèdica, Universitat de Barcelona; Programa contra la Resistència Terapèutica al Càncer (ProCURE), IDIBELL, Institut Català d’Oncologia; Xenopat S.L., Business Bioincubator. El laboratori de Nanobioenginyeria forma part de la xarxa CIBER-BBN.





